Adenosylcobalamine
Tegenwoordig is Adenosylcobalamine een onderwerp dat grote relevantie heeft gekregen in de moderne samenleving. Het belang van Adenosylcobalamine komt tot uiting in verschillende gebieden van het dagelijks leven, van politiek tot technologie, inclusief cultuur en onderwijs. Adenosylcobalamine heeft de aandacht getrokken van zowel experts als leken, wat heeft geleid tot diepgaande discussies, onderzoek en analyses. In dit artikel zullen we de impact van Adenosylcobalamine en de implicaties ervan voor de toekomst onderzoeken, evenals de meningen en perspectieven van verschillende experts over dit onderwerp. Door middel van gedetailleerde analyse zullen we proberen de rol die var1 speelt in de huidige samenleving beter te begrijpen en hoe dit ons leven op korte en lange termijn kan beïnvloeden.
| Adenosylcobalamine | ||||
|---|---|---|---|---|
| Chemische structuur | ||||
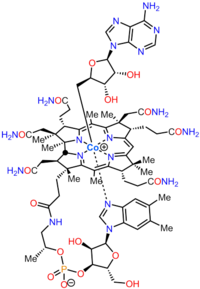
| ||||
▵ Structuurformule van cobalamine. Bovenaan in deze structuur is de desoxyadenosylgroep te zien (aan het kobalt-ion) die afsplitsbaar is
| ||||
| Gebruik | ||||
| Toediening | Oraal | |||
| Databanken | ||||
| CAS-nummer | 13870-90-1 | |||
| ATC-code | B03BA04 | |||
| Chemische gegevens | ||||
| Molecuulformule | C72H100CoN18O17P | |||
| Molmassa | 1.579,61 g/mol | |||
| ||||
Adenosylcobalamine, ook wel co-enzym B12 of cobamamide (AdoCbl), is een van de biologisch actieve vormen van vitamine B12. Samen met de andere cobalamines is het een complexe organische verbinding die van groot belang is voor diverse stofwisselingsprocessen.[1] Adenosylcobalamine is in veel landen in tabletvorm verkrijgbaar.
Adenosylcobalamine neemt als cofactor deel aan herschikkingen van het koolstofskelet van diverse verbindingen. Deze herschikkingen vereisen de vorming van een desoxyadenosylradicaal door homolytische splitsing van de koolstof-kobalt-binding. Deze binding is zeer zwak: het heeft een bindingsdissociatie-energie van 31 kcal/mol, en deze energiewaarde wordt nog lager wanneer het in de buurt komt van het enzymatisch actieve centrum.[2]

Een belangrijk enzym dat adenosylcobalamine als co-enzym gebruikt, is methylmalonyl-CoA-mutase (MCM), dat in de mitochondria verantwoordelijk is voor de oxidatie van aminozuren met een vertakte keten.[3]
Zie ook
- ↑ (en) Marsh EN, Meléndez GD (2012). Adenosylcobalamin enzymes: theory and experiment begin to converge. Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics 1824 (11): 1154–64. PMID: 22516318. DOI:10.1016/j.bbapap.2012.03.012.
- ↑ (en) Kräutler B, Arigoni D, Golding B. (1998). Vitamin B12 and B12-proteins : lectures presented at the 4th European Symposium on Vitamin B12 and B12-Proteins. Wiley-VCH, Weinheim. ISBN 9783527612192.
- ↑ (nl) Schuit, F.C. (2015). Leerboek metabolisme. Bohn Stafleu van Loghum. p. 393. ISBN 978-90-368-0619-0