Ringspanning
In dit artikel zullen we de impact van Ringspanning in verschillende contexten en situaties onderzoeken. Van zijn invloed op technologisch gebied tot zijn effecten op de hedendaagse samenleving is Ringspanning een onderwerp van grote relevantie en betekenis gebleken. Door de geschiedenis heen heeft var1 een cruciale rol gespeeld bij het vormgeven van de wereld waarin we leven, en het belang ervan blijft onderwerp van debat en reflectie op verschillende kennisgebieden. Door middel van een gedetailleerde en uitgebreide analyse zullen we de vele facetten van Ringspanning en de impact ervan op het heden en de toekomst onderzoeken.

Ringspanning (ook wel Baeyerspanning genoemd, naar Adolf von Baeyer) is het verschijnsel dat ringvormige moleculen de neiging hebben om te decycliseren (open te springen), omdat de chemische bindingen in de molecule door hun configuratie in de ring gedwongen verbogen worden ten opzichte van hun meest natuurlijke configuratie. Dit is met name het geval voor kleine ringen, zoals een driering of vierring.
Grootte en oorsprong
De kwantitatieve bepaling van de spanning in cyclische verbindingen kan gebeuren aan de hand van de standaard vormingswarmte ΔH°V. De standaard vormingswarmte van een verbinding is de enthalpie van de reactie voor de vorming van de verbinding uit zijn elementen in hun standaardtoestand (d.i. de meest stabiele toestand bij 298 K en 1 atm). De vorming van lineaire alkanen gaat gepaard met een grote energieafgifte, wat wijst op een stabilisatie van de verbindingen (exotherm proces). Als men de overeenkomstige cycloalkanen beschouwt, dan is deze energieafgifte voor een cyclopentaan en cyclohexaan nog steeds negatief, maar kleiner dan de standaard vormingswarmte van het overeenkomstige lineaire alkaan. Bij cyclopropaan en cyclobutaan is deze warmteafgifte positief, wat wijst op het feit dat de vorming gepaard gaat met energieopname (endotherm proces). Deze verbindingen zijn dus absoluut niet stabiel en bezitten bijgevolg een grote ringspanning.
Het feit dat deze moleculen toch kunnen bestaan heeft meer te maken met de activeringsenergie van de ringopeningsreactie, dan met de energie-inhoud van het molecuul.
Onderstaande tabel geeft deze vergelijkende waarden (in kJ/mol) voor de alkanen en cycloalkanen.
| n | n-alkaan | cycloalkaan |
|---|---|---|
| 3 | -103,7 | +53,1 |
| 4 | -127,1 | +28,4 |
| 5 | -146,7 | -76,9 |
| 6 | -166,8 | -123,3 |
Ringspanningsverloop van de cycloalkanen
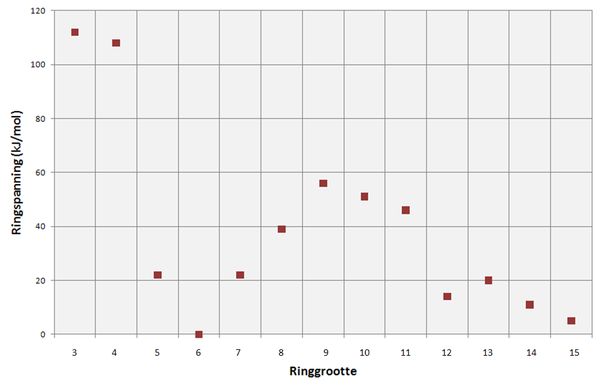
Onderstaande grafiek geeft het verloop van de ringspanning weer in functie van de grootte van de ring (in beschouwing zijn cycloalkanen). Er komen duidelijk 4 gebieden naar voor:
- De zeer kleine ringen (3 - 4) bezitten een zeer hoge spanning
- De normale ringen (5 - 7) bezitten bijna geen spanning en zijn de facto stabiel (vooral cyclohexaan)
- De middelgrote ringen (8 - 11) bezitten een relatief hogere spanning
- De zeer grote ringen (12 - 15) bezitten een relatief kleinere spanning, die afneemt naarmate de ring zeer groot wordt
Voorbeelden
Voorbeelden van moleculen met een grote ringspanning zijn cyclopropaan (C3H6), ethyleenoxide (CH2OCH2) en ethyleenimine (CH2NHCH2). Bepaalde stofklassen omvatten verbindingen met een ongewoon hoge ringspanning, zoals tetrahedranen, propellanen, cubanen, fenestranen en cyclofanen.